Trong phần hóa hữu cơ, các bạn sẽ được học về phản ứng este hóa. Đây là kiến thức rất quan trọng trong môn Hóa Học và xuất hiện nhiều trong các đề thi. Vì thế, bạn cần năm vững kiến thức về phản ứng este hóa cũng như luyện tập nhuần nhuyễn các bài tập về phản ứng este hóa. Sau đây Trung tâm gia sư WElearn sẽ tổng hợp bộ lý thuyết về phản ứng este hóa cùng với cách giải bài tập este hóa.
>>>> Xem thêm: Gia sư Hóa – Dạy Kèm Môn Hóa Tại Nhà
1. Phản ứng este hóa là gì?
Phản ứng este hóa là phản ứng giữa axit cacboxylic và ancol trong điều kiện nhiệt độ, có H2SO4 đặc làm xúc tác. Trong điều kiện đó, đồng thời xảy ra phản ứng thủy phân este trong môi trường axit, tạo ra axit và ancol ban đầu. Phản ứng este hóa và phản ứng thủy phân este trong axit là phản ứng thuận nghịch, hiệu suất phản ứng H <100%.
1.1. Phương trình tổng quát của phản ứng este hóa
- R(COOH)x + R′(OH)t ⇌ Ry(COO)xy R′x + xyH2O (xúc tác H2SO4, t∘)
Nếu axit cacboxylic và ancol tham gia phản ứng đều thuộc loại đơn chức (hay gặp) thì phản ứng có phương trình dạng:
- RCOOH + R′OH ⇌ RCOOH + H2O (xúc tác H2SO4,t∘)
H2SO4 đặc trong phản ứng này ngoài vai trò là xúc tác của phản ứng còn làm nhiệm vụ hút nước.
Ví dụ:
- C2H5OH + CH3COOH ⇌ (H+, to) H2O + CH3COOC2H5
- CH3OH + CH3COOH ⇌ (H+, to) CH3COOCH3 + H2O
1.2. Cơ chế của phản ứng este hóa
Cơ chế phản ứng là quá trình diễn ra phản ứng, đây là phần kiến thức nâng cao, những bạn nào học chương trình Hóa Học nâng cao thì rất cần phải tìm hiểu về cơ chế của phản ứng este hóa.
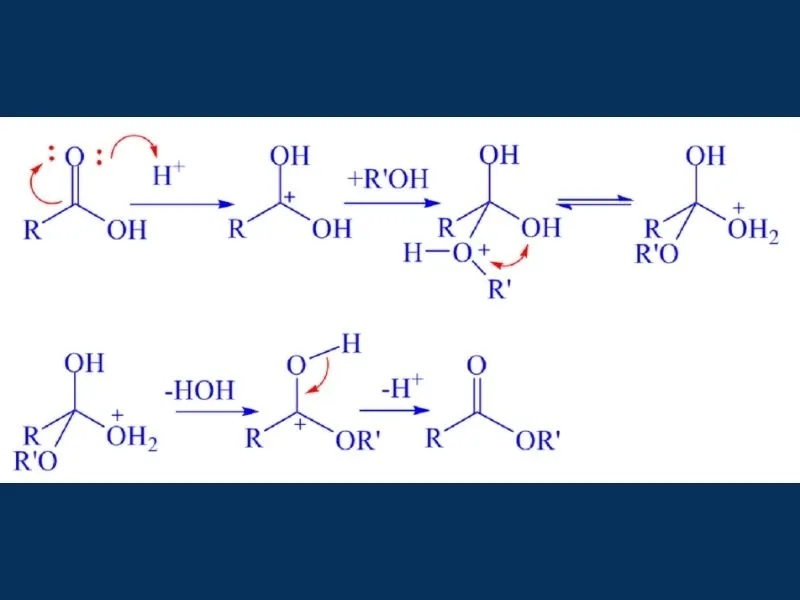
2. Hiệu suất phản ứng este hóa
2.1. Bài toán hiệu suất thuận
- Đề bài cho số liệu của chất tham gia phản ứng, yêu cầu đi tìm các chất tạo thành (sản phẩm).
Công thức tính: H% = (mtt/mlt)*100
hoặc H% = (npu/mbd)*100
- Luôn luôn lấy số liệu của sản phẩm để tính cho bài toán.
- Nếu bài toán cho hiệu suất thì sau khi tính toán chỉ cần nhân với hiệu suất suy ra kết quả cần tìm.
2.2. Bài toán hiệu suất nghịch
Đề bài cho số liệu sản phẩm, yêu cầu tính khối lượng các chất tham gia phản ứng.
Công thức tính: H% = (mtt/mlt)*100
hoặc H% = (npu/mbd)*100
Lưu ý:
- Nếu bài toán đã cho hiệu suất thì sau khi tính toán xong chỉ cần chia kết quả cho hiệu suất suy ra kết quả cần tìm
- Khi đề bài cho chất tham gia ban đầu có chứa bao nhiêu phần trăm tạp chất ⇒ lượng chất tham gia thực tế = lượng chất cho trong đề. (100 – % tạp chất.
- Đề bài cho sự hao hụt trong quá trình phản ứng/ sản xuất thì lượng chất thực tế phản ứng = lượng chất trong đề bài.(100% – % hao hụt).
- Hiệu suất tính theo chất dư ít hơn.
- Khi đề bài cho quá trình gồm n giai đoạn, mỗi giai đoạn có hiệu suất H1,H2,…,Hn,… thì hiệu suất của toàn quá trình là H=H1.H2….Hn
3. Phản ứng xà phòng hóa este
- Phản ứng xà phòng hóa là quá trình thủy phân este trong môi trường kiềm, tạo thành ancol và muối cacboxylat.
- Phản ứng xà phòng hóa là phản ứng 1 chiều, nhưng phản ứng có thể xảy ra hoàn toàn hoặc không hoàn toàn. Hiệu suất phản ứng H≤1, H = 1: phản ứng xảy ra hoàn toàn.
Phương trình tổng quát
Ry(COO)xy R′x + xyNaOH → y(COONA)x + R′(OH)y
m (chất rắn sau phản ứng) = m (muối) + m (kiềm dư)
Với este đơn chức: n (este phản ứng) =nNaOH (phản ứng) = n (muối) = n (ancol)
4. Bài tập về phản ứng este hóa và cách giải
Dạng 1: Tính hằng số cân bằng
Phương pháp tính hằng số cân bằng:

Kc = ([RCOOR′] [H2O]) / ([RCOOH][R′OH]) = x^2 / [(a−x)(b−x)]
Bài tập ví dụ: Cho biết hằng số cân bằng của phản ứng este hóa: R − COOH + R′OH ⇌ R − COOR′ + H2O; có Kc = 4. Nếu cho hỗn hợp cùng số mol axit và ancol tác dụng với nhau thì khi phản ứng este hóa đạt tới trạng thái cân bằng thì có bao nhiêu phần trăm ancol và axit đã bị este hóa?
Giải:
Ta có:
[R1COOR2] = [H2O] = x
[R1COOH] = [R2OH] = a – x
Kc = ([R1COOR2] . [H2O]) / ([R1COOH] . [R2OH]) = x^2 / (a–x)^2 = 4
⇒ x = 2(a–x) ⇔ 3x = 2a ⇒ xa = 23 = 0,667
Vậy khi phản ứng este hóa đạt tới trạng thái cân bằng thì có 66,67% ancol và axit đã bị este hóa.
Dạng 2: Tìm hiệu suất phản ứng este hóa
Phương pháp tính hiệu suất phản ứng este hóa:

Bài tập ví dụ: Trộn 20 ml cồn etylic 92o với 300 ml axit axetic 1M thu được hỗn hợp X. Cho H2SO4 đặc vào X rồi đun nóng, sau một thời gian thu được 21,12 gam este. Biết khối lượng riêng của ancol etylic nguyên chất là 0,8 gam/ml. Hiệu suất phản ứng este hoá là ?
Giải:

Ban đầu số mol ancol nhiều hơn số mol axit suy ra ancol dư, hiệu suất phản ứng tính theo axit.
Theo (1) số mol axit và ancol tham gia phản ứng là 0,24 mol. Vậy hiệu suất phản ứng là :
H = 0,24/0,3 x 100 = 80%.
Bài tập áp dụng
Bài 1: Este phenyl axetat CH3COOC6H5 được điều chế bằng phản ứng nào ?
A. CH3COOH + C6H5OH (xt, to).
B. CH3OH + C6H5COOH (xt, to).
C. (CH3CO)2O + C6H5OH (xt, to).
D. CH3OH + (C6H5CO)2O (xt, to).
Bài 2: Cách nào sau đây dùng để điều chế etyl axetat ?
A. Đun hồi lưu hỗn hợp etanol, giấm và axit sunfuric đặc.
B. Đun hồi lưu hỗn hợp axit axetic, rượu trắng và axit sunfuric.
C. Đun hỗn hợp etanol, axit axetic và axit sunfuric đặc trong cốc thuỷ tinh chịu nhiệt.
D. Đun hồi lưu hỗn hợp etanol, axit axetic và axit sunfuric đặc.
Bài 3: Hỗn hợp M gồm ancol no, đơn chức X và axit cacboxylic đơn chức Y, đều mạch hở và có cùng số nguyên tử C, tổng số mol của hai chất là 0,5 mol (số mol của Y lớn hơn số mol của X). Nếu đốt cháy hoàn toàn M thì thu được 33,6 lít khí CO2 (đktc) và 25,2 gam H2O. Mặt khác, nếu đun nóng M với H2SO4 đặc để thực hiện phản ứng este hoá (hiệu suất là 80%) thì số gam este thu được là
A. 22,80 B. 34,20 C. 27,36 D. 18,24
Bài 4: X là hỗn hợp gồm HCOOH và CH3COOH (tỉ lệ mol 1:1). Lấy 21,2 gam X tác dụng với 23 gam C2H5OH (xúc tác H2SO4 đặc, đun nóng) thu được m gam hỗn hợp este (hiệu suất este hóa đều đạt 80%). Giá trị m là
A. 40,48 gam.
B. 23,4 gam.
C. 48,8 gam
D. 25,92 gam.
Bài 5: Khối lượng riêng của ancol etylic nguyên chất là 0,8 gam/ml. Hiệu suất phản ứng este hoá là:
A. 75%. B. 80%. C. 85%. D. Kết quả khác.
Bài 6: Cho 45 gam axit axetic phản ứng với 69 gam etanol (có H2SO4 đặc làm xúc tác) đun nóng, thu được 41,25 gam este. Hiệu suất của phản ứng este hoá là:
A. 62,50%. B. 50,00% C. 40,00% D. 31,25%.
Bài 7: Cho 45 gam axit axetic phản ứng với 69 gam etanol (có H2SO4 đặc làm xúc tác) đun nóng, thu được 41,25 gam este. Hiệu suất của phản ứng este hoá là:
A. 62,50%. B. 50,00%. C. 40,00%. D. 31,25%.
Bài 8: Khi đun nóng 25,8 gam hỗn hợp ancol etylic và axit axetic có H2SO4 đặc làm xúc tác thu được 14,08 gam este. Nếu đốt cháy hoàn toàn lượng hỗn hợp đó thu được 23,4 g H2O. Tìm thành phần trăm mỗi chất trong hỗn hợp đầu và hiệu suất của phản ứng este hoá.
A. 53,5% C2H5OH; 46,5% CH3COOH và H = 80%
B. 55,3% C2H5OH; 44,7% CH3COOH và H = 80%
C. 60,0% C2H5OH; 40,0% CH3COOH và H = 75%
D. 45,0% C2H5OH; 55,0% CH3COOH và H = 60%
Bài 9: Chia A g axit axetic làm 2 phần bằng nhau.
- Phần 1 được trung hòa vừa đủ bằng 0,5 lít dd NaOH 0,4M;
- Phần 2 thực hiện phản ứng este hóa với ancol etylic thu được m g este. Giả sử hiệu suất phản ứng đạt 100%, giá trị của m là
A. 16,7.
B. 17,6.
C. 18,6.
D. 16,8.
Phản ứng este hóa là phần kiến thức khá quan trong trong chương trình môn Hóa Học. Những chia sẻ trên đây của WElearn chắc chắn sẽ hữu ích với các bạn. Hãy luyện tập thật nhiều để nhuần nhuyễn dạng bài tập về phản ứng est nhé! Chúc các bạn học tốt.
