Blog Giáo Dục
Lợi Ích Của Tin Học Trong Học Tập, Công Việc Và Đời Sống
Trong thế giới hiện đại ngày nay thì tin hoc là một món quà to
Cách Giảng Bài Hay Đơn Giản Dành Cho Gia Sư
Việc truyền tải kiến thức đến học sinh một cách cuốn hút và giúp các
Hướng Dẫn Ôn Thi Đại Học Môn Toán Từ A Đến Z
Môn Toán là một trong những môn chính để thi xét điểm thi đại học
Tổng Hợp Các Câu Hỏi Olympia Môn Toán Hay Nhất
Olympia là một kỳ thi với nhiều kiến thức tổng hợp. Và môn toán cũng
Kinh Nghiệm Dạy Kèm Cho Trẻ Lớp 1 Cha Mẹ Nên Biết
Dạy con học ở nhà không phải là việc đơn giản. Khi các bậc phụ
Hướng Dẫn 31 Cách Dạy Học Online Hiệu Quả
Dạy online là phương pháp dạy mới được phát triển trong 2 năm gần đây,
TOEIC Là Gì? Học TOEIC ở Đâu Tốt TPHCM?
TOEIC là bài thi tiếng Anh quốc tế. Khi có chứng chỉ TOEIC với số điểm
Cách Dạy Trẻ Lớp 1 Tính Nhẩm Dễ Dàng Dành Cho PHHS
Tính nhẩm là một kỹ năng cực kỳ quan trọng. Bạn cầ luyện tập cho
Xóa Tan Nỗi Ám Ảnh Môn Hóa Với Các Cách Học Tốt Hóa 9
Hóa học là môn học có lượng lý thuyết và bài tập khá nhiều, đăc
Bật Mí Cách Luyện Chữ Đẹp Cho Người Lớn Nhanh Chóng
“Nét chữ – nết người”. Không phải chỉ những học sinh mới cần viết chữ
Cách Vẽ Sơ Đồ Tư Duy Môn Hóa Dễ Nhớ Bài
Học qua sơ đồ tư duy là một trong những cách học hay nhất, giúp
Cách Học Tốt Môn Lý 12: Bí Quyết Từ Thủ Khoa Lý
Lý lớp 12 là môn học “khó nhằn” nhất trong chương trình Lý THPT. Vì
Hướng Dẫn Cách Học Tốt Hóa 11 Hiệu Quả Nhất
Hóa 11 là chương trình hóa nặng nhất trong 3 năm cấp 3. Vì nó
Kinh Nghiệm Học Tốt Toán 6 Của Nhiều Học Sinh Giỏi
Toán lớp 6 là nền tãng để các năm cấp 2 học tốt hơn. Vì
Cách Học Tốt Môn Hóa 12 Để Luôn Đạt Điểm Cao
Môn Hóa lớp 12 là một trong những môn khá quan trọng và nằm trong
Tổng Hợp Các Vấn Đề Trong Trường Học Hiện Nay
Ngày nay, cùng với sự phát triển về kinh tế là những vấn đề xã
2 Comments
Top 7 Cách Ôn Thi Đại Học Khối A Hay Và Hiệu Quả
Khối A là khối hầu như được các bạn học sinh chọn nhiều nhất vì
Cách Học Tốt Môn Toán 11 | Bí Quyết Đạt Điểm Cao Toán 11
Toán 11 là một trong những phần khá quan trọng. Vì nó là nền tảng
Tổng Hợp Các Dạng Toán Nâng Cao Lớp 6 Đầy Đủ Nhất
Lớp 6 là cột mốc cực kỳ quan trọng của các em học sinh. Vì
4 Comments
Làm Thế Nào Để Siêng Học Và Loại Bỏ Lười Biếng?
Tâm lý chung của mỗi người chúng ta là luôn chọn “đường dễ để đi”
2 Comments
Nghề Giáo Viên Trong Tương Lai: Cơ Hội Hay Thách Thức?
Nghề giáo là nghề cao quý nhất trong những nghề cao quý. Tuy nhiên, ngày
Các Vấn Đề Bất Cập Của Việc Học Tại Trường
Sau phong trào bình dân học vụ năm 1945, có lẽ chưa bao giờ Giáo
Hướng Dẫn Rèn Chữ Cho Bé Lớp 1 Đúng Đẹp Chuẩn
Ngoài việc truyền tải thông tin thì chữ viết còn là căn cứ để đọc
Có Nên Tìm Gia Sư Trước Tết Cho Con Không?
Tết là kỳ nghỉ được các em học sinh mong chờ nhất. Các em được
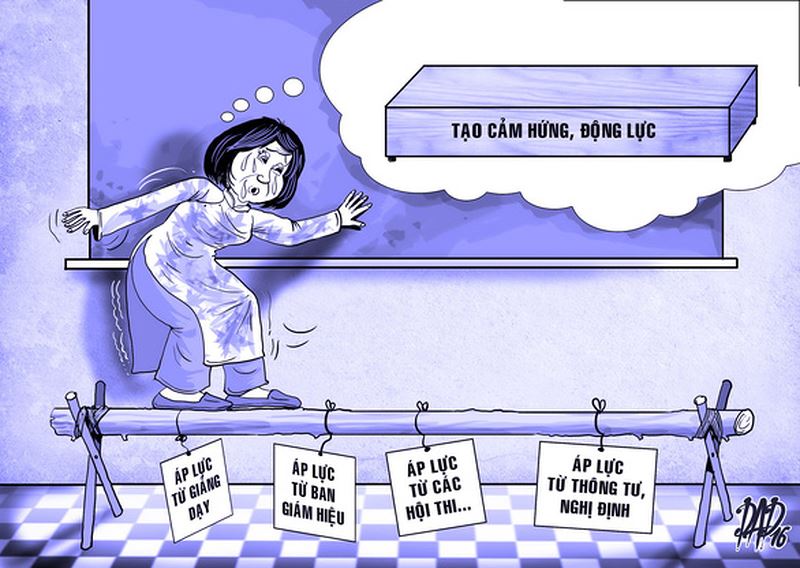
Nỗi Khổ Của Giáo Viên Và Gia Sư Khi Giảng Dạy
Trở lại hành lang quen thuộc ngày nào sau hơn tám năm buộc phải trưởng
Có Nên Học Chương Trình Tiếng Anh Tích Hợp Không?
Chương trình tiếng Anh tích hợp đang khá “hot” trong thời điểm hiện nay. Nhiều
Có Nên Cho Bé Lớp 2 Học Tiếng Anh Không?
Có nên cho bé lớp 2 học tiếng Anh? Là câu hỏi chung của hầu
Những Sai Lầm Khi Dạy Kèm Bé Học Tại Nhà
Không ít phụ huynh đau đầu vì không biết làm sao để con tự học.
Bí Quyết Học Tốt Môn Hóa 10 Cực Hiệu Quả
Hóa Học có lượng kiến thức khổng lồ về cả lý thuyết lẫn bài tập.
Tại Sao Lớp 4 Là Lớp Khó Nhất Trong Chương Trình Tiểu Học?
Không còn phải làm những phép tính đơn giản như cộng trừ nhân chia, hay
Danh Sách Các Trường Trung Học Cơ Sở Quận 8
Dưới đây là tổng hợp danh sách các trường trung học cơ sở quận 8
Top 10 Nhà Toán Học Việt Nam Nổi Tiếng Và Thành Công
Đất nước Việt Nam của chúng ta tuy nhỏ nhưng lại không thiếu những nhân
- 1
- 2